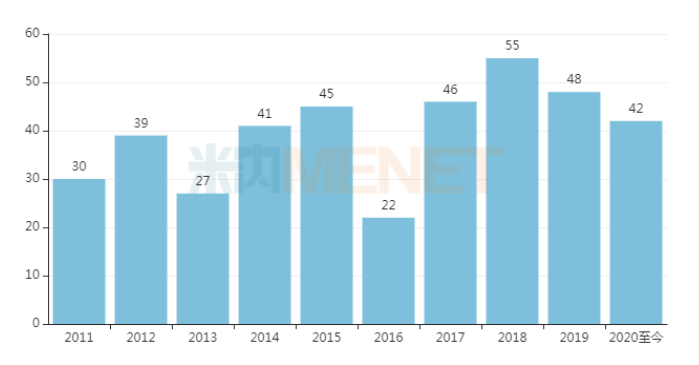
根据美国食品药品监督管理局(FDA)官方网站公布的最新数据,2020年10月FDA共批准两款创新药物,分别是再生元的Inmazeb和吉利德的Veklury。2020年前十个月美国FDA已经陆续批准了42款创新药物,包括32个新分子实体(NME)和10个新生物制品。
2020年10月,美国FDA仅批准两款创新药物,数量虽少,但都是属于全身用抗病毒的重磅药物。一款是再生元治疗埃博拉病毒感染的Inmazeb(atoltivimab, maftivimab, and odesivimab-ebgn),这是全球首款获批用于治疗埃博拉病毒感染的药物;另外一款是针对新型冠状病毒感染的治疗药物Veklury(瑞德西韦),这是全美首款批准用于治疗新型冠状病毒的药物。

2020年10月14日,美国食品和药物监督管理局(FDA)批准再生元公司开发的Inmazeb(atoltivimab, maftivimab, and odesivimab-ebgn)上市,用于治疗感染扎伊尔型埃博拉病毒(Zaire ebolavirus)的成人和儿童患者,包括母亲感染检测呈阳性的新生儿。Inmazeb是全球首款获批用于治疗埃博拉病毒感染的药物,该药由3种全人IgG1单抗组成的“鸡尾酒疗法”,由再生元利用专有的VelociSuite快速反应技术开发。Inmazeb曾获得美国FDA授予了孤儿药、突破性疗法两项资格认定。
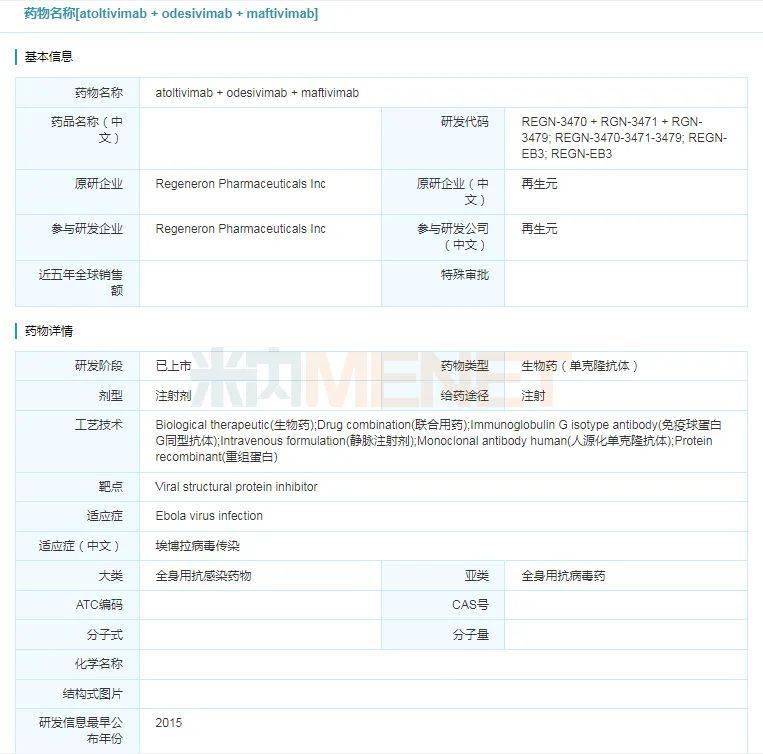
埃博拉病毒是一种能引起人类和动物产生出血热的烈性传染病病毒,是迄今发现的致死率最高的病毒之一,致死率高达50%-90%,致死原因主要为中风、心梗、休克等,症状还包括发烧、头痛、乏力、腹泻、呕吐、关节和肌肉疼痛等。埃博拉病毒主要在非洲地区流行,2013年至2016年期间西非地区埃博拉病毒的大规模爆发事件摧毁了几内亚、塞拉利昂和利比里亚的公共卫生基础设施,造成28646人感染,11323人死亡。
Inmazed在一项名为PALM的多中心、开放标签、随机对照的临床试验中的优异表现为此次批准奠定了基础。在该试验中,168名患者接受了试验性对照。试验结果表明,在接受Inmazeb治疗的患者中有33。8%的患者在28天后死亡,相比之下,对照治疗的患者中有51%的患者死亡,接受Inmazeb治疗的患者获得的生存机会与对照组相比更大。
目前,全球已获批上市的治疗埃博拉病毒感染的产品也仅有两款,默沙东的疫苗Ervebo(V920)2019年11月在欧盟获得批准,随后在美国、非洲4个国家获得批准,用于18岁及以上人群的主动免疫,以预防由扎伊尔型埃博拉病毒引起的埃博拉病毒病。还有一款是强生公司的埃博拉预防性疫苗方案:两针免疫方案(Zabdeno、Mvabea)在今年6月获得欧盟批准,用于年龄1岁及以上人群的主动免疫,以预防由扎伊尔埃博拉病毒株引起的埃博拉病毒病。
2020年10月22日,美国食品和药物监督管理局(FDA)正式批准吉利德的抗新冠病毒药物Veklury(瑞德西韦)上市,用于治疗12岁及以上、体重至少40千克的儿童和成年患者。瑞德西韦在新型冠状病毒疫情以来备受瞩目,曾被称为“人民的希望”。2020年5月1日,美国FDA为瑞德西韦发放了治疗新冠肺炎的紧急使用授权(EUA)。日本在5月7日批准了该药物作为日本首款新冠肺炎治疗药物,被用于治疗重症患者。目前,Veklury已获得全球约50个国家批准或授权临时用于新冠病毒感染的治疗。
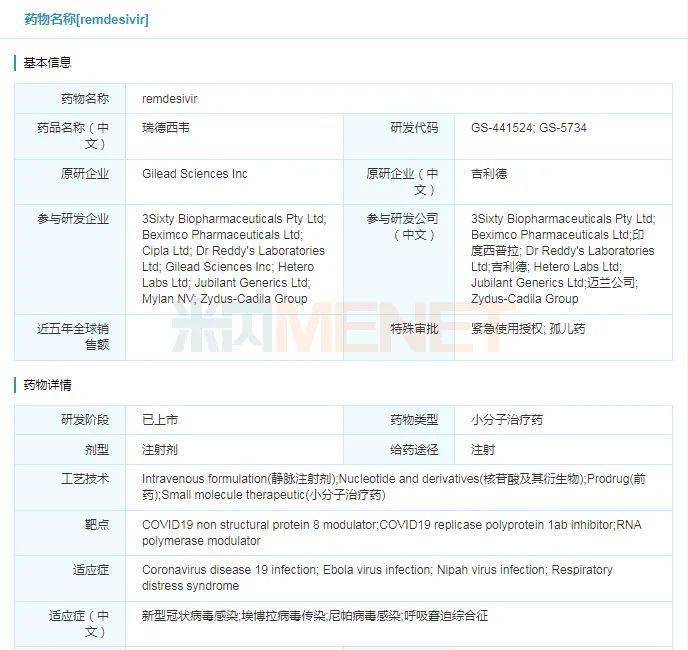
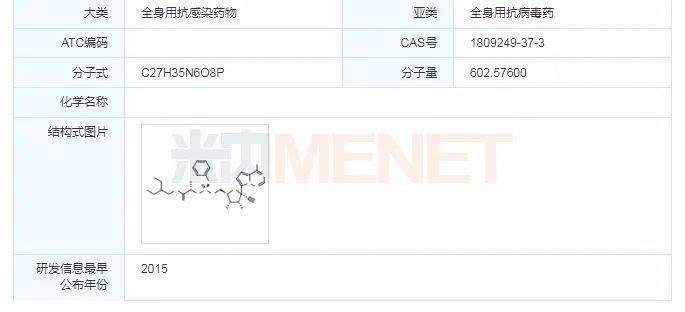
截至美国东部时间10月31日,美国新冠肺炎累计确诊病例已经超过910万例,累计死亡病例达到20万例,美国新冠疫情仍持续恶化。在这背景下,FDA致力于加快新型冠状病毒治疗方法的开发和利用,作为美国FDA冠状病毒治疗加速项目的一部分,Veklury(瑞德西韦)的上市申请获得FDA的优先审查和快速通道资格,其正式批准代表了新冠大流行中的一个重要科学里程碑。值得一提的的是,这一批准并不包括其紧急使用授权(EUA)的机制下被授权的所有人群,为了确保继续接触先前受EUA覆盖的儿童人群,FDA修订了Veklury的EUA,授权该药用于治疗疑似或实验室确认的新冠患者并且体重在3。5千克至40千克以下的住院儿科患者或12岁以重至少3。5千克的住院儿科患者。目前该药正在进行临床试验,以评估在儿童患者群体中的安全性和有效性。
此次批准基于3项随机对照试验,其中美国国家过敏和传染病研究所进行的多中心随机双盲对照研究ACTT-1,是FDA参考的核心数据。FDA的公告文件中表示,该试验的最终结果表明,在观察的轻症、中症和重症1062名新冠患患者中,与安慰剂相比,接受Veklury治疗的患者较安慰组在第15天临床症状改善上比例更高。而在另外的2项试验中,Veklury治疗组与安慰组比较在关键指标上没有显著差异。
关于瑞德西韦的治疗效果一直争议不断半岛·综合体育中国官网。在美国FDA宣布正式批准瑞德西韦的前两周,世界卫生组织(WHO)发布了一份针对30个国家405家医院共11266位患者进行的临床试验的结果。研究发现该药物不仅未能防止患者死亡,甚至无法加速患者的康复过程,对于新冠患者住院治疗影响很小或没有影响。随后,吉利德发布声明反驳,认为WHO的研究数据与临床试验并不可靠?
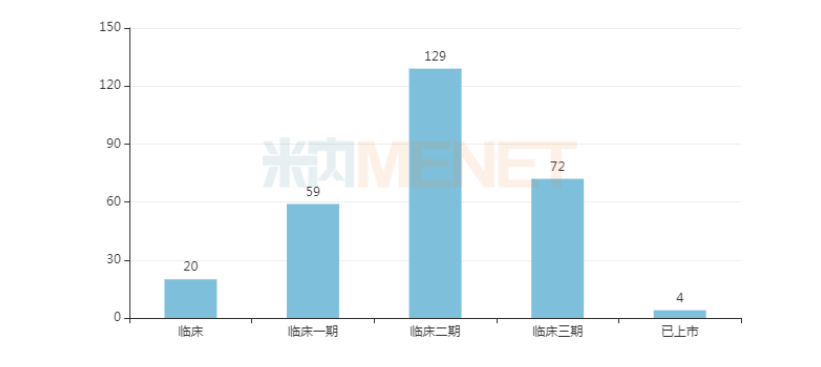
新冠治疗药物/疫苗是新冠疫情以来,受各界关注的重点,全球有几百款药物正积极开发与新冠有关的适应症。米内网全球药物研发库的数据显示,目前全球至少有284种药物正处于临床及以上阶段,其中适应症为新型冠状病毒感染的已上市的药物有4种,分别为:瑞德西韦、法匹拉韦、连花清瘟胶囊和俄罗斯新冠疫苗Sputnik V。除此之外,处于临床三期的药物有72种、处于临床二期的药物有129种、处于临床一期的药物有59种,处于临床阶段的药物有20种。
注:资料来源于FDA官网、企业公告、米内网数据库,如有错漏,敬请指正。返回搜狐,查看更多!

访问手机版

微信公众号